Contents
結論
AMR(薬剤耐性)への対策は国際的な問題
特に抗菌薬への耐性を獲得したグラム陰性菌(MDR-GNB)への対策は重要
感染の基本は迅速な診断と適正な抗生物質の使用
基盤として、適正な感染症伝播への管理は重要
今回の論文
https://www.thelancet.com/journals/lancet/article/PIIS0140-6736(24)02081-6/abstract
おまけ
セフィデロコールと高用量メロペネムの比較(APEKS-NP)
https://www.thelancet.com/journals/laninf/article/PIIS1473-3099(20)30731-3/abstract
セフィデロコールの有効性・安全性(CREDIBLE-CR)
https://www.thelancet.com/journals/laninf/article/PIIS1473-3099(20)30796-9/abstract
抗菌薬耐性(AMR)
公衆衛生上の重要な課題の1つ
2021年で、細菌性AMR関連の死亡者は推定471万人
低所得・中所得国が多く影響を受けている
脅威の大部分はMDR-GNB
MDR-GNBの拡大は、抗生物質の誤用・過剰使用、衛生設備の不足、医療の複雑さの増大、感染予防管理の不十分さなど、複数の要因が関与
耐性・伝播
プラスミドなど可動性遺伝性要素の伝達でAMRを広めることができる
AMRは拡大しつづけ、カルバペネム、ポリミキシン、さらに新しいβラクタムと阻害薬の組み合わせなどの最終手段ですら耐性が報告されている
すなわち、全薬剤耐性が現実味を帯びている
MDR-GNBによる感染症は、非耐性と同じ
当たり前の話ですが、耐性菌であってもそうでなくても、感染症しての原則は同じです.
すなわち、ドレナージやデブリードメントは感染管理の基盤です.
抗生物質はあくまでも、補助的な(といっても中心なのですが)役割であるという認識が必要です。
一般的な感染症である、肺・肝胆道・腹腔・尿路・皮膚軟部組織などに感染症を来します.
MDR-GNBのリスク因子は、抗菌薬の使用、過去の定着、流行地域への渡航、透析、過去の集中治療室滞在や人工呼吸管理などとされています.
診断
PCR、質量分析、細菌全ゲノム配列など進化しています.
治療は、新しいβラクタムとβラクタマーゼ阻害薬の組み合わせ
テトラサイクリン、アミノグリコシド、新しいシデロフォア様セファロスポリン(セフィデロコール)などがあります.
AMRの臨床的に重要なメカニズム
以下のようなメカニズムで耐性を示す
・抗生物質の修飾または分解(例;βラクタム系抗生物質のβラクタマーゼ加水分解)
・細菌細胞への侵入の減少(例;ポリン喪失)
・抗生物質の標的部位の変更(例;リボソームの変化)
・細菌細胞からの抗生物質の排出の増加(例;膜貫通排出ポンプの過剰発現)
AMRの定義
2012年にAMRの国際標準化用語が策定されました.
多剤耐性(MDR)は3種類以上の抗生物質カテゴリーで、少なくとも1つの薬剤に対する後天的な非感受性と定義.
広範囲薬剤耐性は1つまたは2つのカテゴリーを除く全ての抗生物質カテゴリーで、少なくとも1つの薬剤に対する非感受性と定義.
汎薬剤耐性は、全ての抗生物質カテゴリーの薬剤に対する非感受性と定義.
治療困難耐性(DTR)の臨床定義が策定
全ての第一選択薬、つまりカルバペネムとβラクタマーゼ阻害薬の併用(新規併用は除く)を含む全てのβラクタム、フルオロキノロンに対する治療制限耐性と定義
この定義は毒性の低い第一選択薬と、
アミノグリコシド、ポリミキシン(腎毒性があり腹部や肺への浸透性が低い)
チゲサイクリン(血清濃度が低く、肺への透過性が低い)
などの毒性が高く効果の低い薬剤を区別している
臨床的に関連する多剤耐性グラム陰性病原体
腸内細菌:Enterobacterales
大腸菌、クレブシエラ、プロテウス属
および医療関連のエンテロバクター属、セラチア
腸内細菌科細菌の耐性メカニズム
狭域スペクトルペニシリン(ベンジルペニシリン、アモキシシリン)と第3世代セファロスポリン(セフトリアキソン、セフタジジム)に対する耐性を付与する.
広域スペクトルβラクタマーゼ(ESBL)とAmp-C βラクタマーゼ、カルバペネム(メロペネム、イミペネム、エルタペネム)に対する耐性を付与するカルバペネマーゼ.
WHOは第3世代セファロスポリン耐性およびカルバペネム耐性腸内細菌科細菌(CRE)を新薬開発の重要な優先病原体と宣言.
ESBLは抗生物質のβラクタム環を加水分解
活性部位にセリンをもつ酵素の異種グループ
プラスミドなどの可動性遺伝要素に位置することが多く、細菌病原体間での急速な水平伝播につながる
これらの酵素をもつ細菌は、第3世代セファロスポリンに対する耐性を付与するが、カルバペネムには感受性がある
腸内細菌科ESBLの疫学
西ヨーロッパでは5−25%
南ヨーロッパでは50%以上
ラテンアメリカでは30%
米国では11−13%
アジアでは30−80%
オーストラリアとニュージーランドでは10−15%
Amp-C βラクタマーゼ
Enterobacter spp
S.marcescens
Citrobacter freundii
Morganella morganiiおよびProvidencia spp
これらの病原体は,第3世代セファロスポリンに耐性だが,セフェピムやカルバペネムには感受性があることが多い
ESBLとAmpCの区別
AmpCは一部のβラクタマーゼ阻害薬(グラブラン酸)およびセファマイシン(セフォキシチン)に対し耐性である点から区別できる
AmpC遺伝子はほとんどの場合,染色体上に位置し,その発言は第3世代セファロスポリンを含む様々なβラクタムへの暴露により誘導される可能性がある
その発現は第3世代セファロスポリンを含むさまざまなβラクタム系抗生物質への暴露によって誘導される可能性がある
細菌は当初これらの薬剤に対しIn vitroで感受性を示すが,誘導が続くと耐性を獲得する
誘導性染色体AmpC発現が顕著なのは,Enterobacter cloacae複合体,Klebsiella aerogenes,C freundiiである
対して,S.marcescens, M.morganii, Providencia属では誘導性AmpC発現レベルが低い
そのため,第3世代セファロスポリン耐性を発現する可能性は低い
プラスミド媒介AmpC遺伝子
K pneumoniae
E.coli
Salmonella属
これらで典型的に検出され,誘導を必要とせずに耐性を付与する
カルバペネマーゼ
カルバペネムを含む幅広いβラクタムを加水分解する酵素
さらに活性部位のセリン残基に依存するカルバペネマーゼ(KPC; Klebsiella pneumoniae karbapenemase),IMI(Imipenem hydrolysing βlactamase, OXA-48 group)
亜鉛に依存するメタロβ-ラクタマーゼとしても知られるカルバペネマーゼ(NDM; New delhi metallo beta lactamase, VIM(Verona integron encoded metallo beta lactamase and imipenemase(IMP))に分類できる
酵素特異的な新しいβラクタマーゼ阻害薬の登場で,より最適な抗生物質の選択に役立てるため,カルバペネム耐性のメカニズムを知ることが重要になっている
腸内細菌科細菌におけるカルバペネム耐性は,ESBL過剰産生,ポリン変異・喪失,排出ポンプの情報制御などの非カルパペネマーゼ機構によっても生じる可能性がある
地域による耐性
世界的には腸内細菌科細菌におけるカルバペネム耐性率は10%未満だが,地域間で大きなばらつきがある
ギリシャとロシアのK,pneumoniae分離株の50%以上はカルバペネム耐性
耐性率は菌腫によっても異なり,K.pneumoniaeではカルバペネム耐性が多く,カルバペネマーゼ産生菌の割合が高い
優勢にカルパペネマーゼの種類も地域によって異なり,北米・アジア・南ヨーロッパではKPCが最も一般的
インド亜大陸,中東,バルカン半島ではNDM,アジア・オーストラリアではIMPが優勢
緑膿菌
P.aeruginosaは一般的な院内感染症の原因菌
容易に複数の抗生物質に対する耐性を獲得する可能性がある
腸内細菌科による耐性は獲得したβラクタマーゼにより引き起こされる
P.aeruginosaは,複数の抗生物質を能動的に除去する排出ポンプ(MexAB-OprM)の存在,抗生物質の透過性を低下させるポインの変異(OprD)に起因することがある
これらの因子は,染色体AmpC型βラクタマーゼである,Pseudomonas由来セファロスポリナーゼ(PDC)の過剰発現と連携して作用する
これら内因性メカニズムに加え,P.aeruginosaはβラクタマーゼ遺伝子やキノロン耐性などのプラスミドを介して耐性メカニズムを獲得する事もできる
緑膿菌のカルバペネム耐性率は世界的に10-20%,多剤耐性率は地域や感染部位によって5-30%
Acinetobacter baumannii
P.aeruginosaと同様に
ポリン変異,複数のβラクタマーゼ,アミノグリコシド修飾酵素,排出ポンプの酸性など,複数の共存メカニズムにより生じる
カルバペネム耐性の上昇につながる最も懸念される展開は,主にOXAおよびメタロβ-ラクタマーゼ(IMP,NDM,VIM)のカルパペネマーゼの獲得である
最近の世界調査の結果では,カルバペネム耐性分離株の91%がカルパペネマーゼ遺伝子を保持している.
bla OXA-23が88%を占めていた
A.baumanniiでも他のGNRでも同じ細菌が複数のカルパペネマーゼを獲得する可能性がある
A.baumanniiのカルバペネム耐性率は世界的に30%を超え,南ヨーロッパなど多くの地域では50%を超え,アジアでは80%を超えている.
診断における最近の進歩
AMRの迅速な診断は治療の指針となり,抗生物質の使用の適時性と適切性により,患者の転帰を改善する
耐性検出の培養結果と定性・定量検査は一部自動化されいてるが,28-48時間と時間を要する
MDR-GNBではさらに長時間を要する場合ある
現在の迅速診断
複数の生化学検査があり,特にカルパペネマーゼの検出に重点が置かれている
CarbaNP(カルパペネマーゼ酸性の存在を検出するために開発された検査)などの検査は,コリスチンやセフィデロコール耐性の検出にも応用されている.
最近の研究では,blaKPCカルパペネマーゼ遺伝子のPCR検査は,CRE菌血症患者の有効な抗生物質両方の投与の迅速化(中央値24時間 vs 50時間)と14日死亡率(16% vs 37%)の低下に寄与していることが示された
治療
過去10年でMDR-GNBに有効な抗生物質が臨床現場で使用されている
4つの主要要因を考慮したMDR-GNB治療の枠組みが重要となっている
1. 感染部位
2.感染の重症度
3. 感染を引き起こしている細菌性病原体
4. 関与している可能性のある耐性メカニズム(SEBL, Amp-C, KPC, NDMなど)
国際ガイドラインでは,これら4つの要因に基づき分類している
MDR-GNBに対する抗生物質
ST合剤,キノロン,nitorofurantoinなどは,in vitro感受性がある場合は,一部のMDR-GNB(例;尿路感染症)に有用
エルタペネムはESBLにより加水分解される可能性があり,治療前に感受性を確認することが必要
エルタペネム耐性でメロペネム感受性の場合は,メロペネムを使用することができる
MERINO試験は有名だが,抗生物質感受性試験法を用いてMERINOのデータを再分析したところ,この差は統計的に有意で無いことが示された
これらの検証をおこなうため,PETERPEN研究などが進行中
多数の観察研究にもとづくと,確率されたβラクタムおよびβラクタマーゼ阻害薬(P/T)は重篤でない第3世代セファロスポリン耐性腸内細菌感染症において,臨床的改善がみられる場合は治療の継続として潜在的な役割を果たす可能性がある
AmpCを産生する腸内細菌科細菌(例,エンテロバクター属)には,セフェピムの使用を検討
ESCMID(欧州微生物学会および感染症学会)のガイドラインではデータが不足しているため,第3世代セファロスポリン耐性腸内細菌科にはセフェピムの使用を推奨していないが,IDSA(米国感染症学会)のガイドラインでは,かなりのAmpC産生のリスクが中程度のAmpC産生腸内細菌科(例,E.cloacae複合体,K.aerogenes,C.freundii)にはセフェピムが適切である可能性が示されている
アミノグリコシド
多くのMDR-GNBの治療選択肢,特に尿路感染症に有用
感受性がある場合は,第3世代セファロスポリン耐性腸内細菌科,CRE,DTR-P aeruginosaによるUTI代替治療薬措定推奨
腎毒性,耳毒性のリスクがあり,長期使用は難しい
ポリミキシン(コリスチン,ポリミキシンB)はグラム陰性細菌の外膜のリポ多糖と相互作用し透過性を高め,細胞死を引き起こす陽イオン化合物
これらはCREの第一選択だったが,腎毒性作用などが強く,セフタジジム-アビバクタムなどのβ-ラクタムとβ-ラクタマーゼ阻害薬の組み合わせに置き換えられた
併用療法の一部としてポリミキシンは重篤なカルバペネム耐性A.baumannii(CRAB)治療の選択肢
他のどの抗生物質クラスにも感受性のないMDR-GNB感染症に効果がある可能性
テトラサイクリン誘導体
CRABおよびCRE治療の併用療法の選択肢として残っていますが,緑膿菌には効果がない
チゲサイクリンは静脈内投与後の組織分布が早く,血清および尿中の濃度が低くなるためこれらの部位の感染症には注意が必要
チゲサイクリンは肺への浸透性も低く,人工呼吸器関連肺炎として治療するには懸念がある
チゲサイクリンは腹腔内および皮膚軟部組織感染症治療として適している
CRAB,CRE感染症には,チゲサイクリンを高用量で使用することが推奨(静脈投与量で200mgの負荷投与,その後1日100mg)
ホスホマイシン
ESBL-E.coliまたはCRE-E.coliによる単純性尿路感染症の代替治療薬
いくつかのグラム陰性菌(K.pneumoniae含む)は,fosA遺伝子の存在によりホスホマイシンに対する固有の耐性を有し,臨床的治療失敗に繋がる可能性
RCTでは尿路からのESBL E.coli血流感染症に対する静脈内ホスホマイシンは,β-ラクタム療法に対し非劣性を示さなかった
これはホスホマイシン群で副作用のため中止された影響を加味する必要があり臨床的治癒は両群で同等
スルバクタム
ペニシリン結合蛋白の飽和を開始,A.baunannii(CRAB含む)に対する活性を有する不可逆的な競合性β-ラクタマーゼ阻害薬
これはスルバクタムに特有で,他のβ-ラクタマーゼ阻害薬には見られない特徴
CRAB感染症の治療オプションとして少なくとも1つの他の抗生物質と併用した高用量スルバクタムが推奨され,通常はアンピシリンスルバクタムとして使用される
MDR-GNBに対する新しい抗生物質
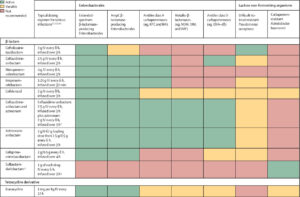
この表はアンチバイオグラムの表のように見やすいです.
セフトロザンタゾバクタムは新しい,第5世代セファロスポリンとβ-ラクタマーゼ阻害薬を組み合わせたもの
セフトロザンのペニシリン結合蛋白質に対する親和性が向上し,ポリン変異や排出ポンプの採用を受けにくくなり,カルバペネム耐性,DTR-P.aeruginosaの治療に役立つ
サーベイランス研究では,すべてのP.aeruginosa分離株の66-98%がセフトロザンタゾバクタムに感受性がある
これはMDR P.aeruginosa分離株の63-95%が含まれる
すなわちセフトロザンタゾバクタムはin vitroで活性がある場合,重篤なDTR-P.aeruginosa感染症の第一治療薬として広く受け入れられている
ESBL-Enterobacteralesに対するセフトロザンタゾバクタムの活性はまちまちで,ESBL E.coliに対する感受性率は高い(66-100%)
しかし,ESBL K.pneumonioeに対する活性は限定される(42-84%)
セフタジジムアビバクタム,メロペネムバボルバクタム,イミペネムレレバクタムなどがある
これらは現在,CRE治療の第一選択薬であり,その活性はカルバペネマーゼのクラスにより異なる
これらの併用療法は,アンブラークラスAカルバペネマーゼ(KPC)を産生するほとんどの微生物に対して活性だが,OXA-48などのアンブラークラスDカルバペネマーゼを産生する微生物に対し活性を示すのはセフタジジムアビバクタムのみ
ペロペネムバボルバクタムはKPC産生細菌に対する耐性発現の可能性が低い可能性があることが示されている
これらの薬剤は単独ではメタロβ-ラクタマーゼ(アンブラークラスBカルバペネマーゼ,NDM,VIM,IMP)を産生する微生物に活性ではない
セフタジジムアビバクタムとアズトレオナムの併用治療がESCMIDガイドラインとIDSAガイドラインの両方で推奨される
アズトレオナムは,メタロβ-ラクタマーゼに対し安定性のあるモノバクタムβラクタムであり,アビバクタム(セフタジジムアビバクタムとして投与)はアズトレオナムを分解し,メタロβ-ラクタマーゼ産生菌に同時に存在する事が多いセリンβラクタマーゼを阻害する
セフタジジムアビバクタムおよびイミペネムリレバクタムもMDR-P.aeruginosaaに対し有効
感受性率はセフタジジムアビバクタムで68-89%,イミペネムリレバクタムで59-60%
ガイドラインの比較

表の文字は見えないと思いますので,詳しくは原文をご参照ください.
DTR-P.aeruginosa治療ではIDSAは条件付き推奨としており,ESCMIDとは異なる
セフェピムとエンメタゾバクタムは,ESBL(CTX-M,SHV,TEM),Amp-C,OXA-48産生腸内細菌科細菌に対する活性を持つ新しい組み合わせ
この組み合わせは複雑性腎盂腎炎治療における,ピペラシリン・タゾバクタムに対する非劣性を示した第3相試験のあと,2024年にEMAとFDAに承認された
スルバクタムとデュロバクタムの併用は最新の配合剤の1つで,CRAB感染症を標的として特別に開発された
スルバクタムはペニシリン結合蛋白の付着を介し,A.baumanniiに直接作用し,アンブラークラスA,CおよびD βラクタマーゼ(OXAカルバペネマーゼを含む)を阻害する
第3相試験では,コリスチンに対し非劣性を示し,腎毒性の発生率が統計的に低いことが示された
FDAにより院内肺炎,人工呼吸器関連肺炎の治療薬として承認された
代替療法の不足を考慮すると,スルバクタムとデュロバクタムはCRAB感染症のあらたな治療選択肢
IDSAにより第一選択療法として(カルバペネム併用で)推奨された
試験ではスルバクタムデュロバクタムがイミペネム・シラスタチンと併用されたが,臨床使用における補助カルバペネム療法の役割はまだ確立されていない
デュロバクタムはメタロβ-ラクタマーゼ(NDM)に対して活性がなく,メタロβ-ラクタマーゼ産生CRAB感染症治療には代替療法を検討すべき
一部の国ではCRABの有病率が高くスルバクタムとデュロバクタムの併用が利用できず,同様の効果を狙ったあまり研究されていない併用療法が検討されている
デュロバクタムと同様に,アビバクタムはアンブラークラスA.CおよびDのβ-ラクタマーゼを阻害する
アビバクタムとスルバクタムの併用はCRABの潜在的治療薬として提案されているが臨床データはない
セフィデロコールは,新しい作用機序をもつシデロフォアセファロスポリン
鉄に結合することで,鉄トランスポーターを介して細菌細胞に入りやすくなる
β-ラクタマーゼ,ポリン変異,排出ポンプから細菌を保護する
その結果,セフィデロコールはほとんどのMDR-GNBにに対し幅広いin vitro活性を示し,感受性率はCRE(すべてのカルパペネマーゼ含む)に対し97%,カルバペネム耐性P.aeruginosaに対し97%,CRABに対し95%
耐性はメタロβ-ラクタマーゼ産生腸内細菌科の24.9%,A.baunanniiが40.9%であることは考慮すべき
最も問題となるのはNDM産生菌で耐性率は38.8%
CREDIBLEーCRはカルバペネム耐性グラム陰性菌感染症の患者を対象にセフィデロコールと最善治療を比較したもので,臨床的・微生物学的有効性は同等だがアシネトバクター属感染症死亡がセフィでロコール群で多かった
CRABの場合IDSAではセフィデロコールは他の抗生物質に反応しない,または抗生物質に不耐性がある感染症に限定して使用することを推奨している
ESCMIDでは条件付きで使用を推奨していない
イタリアの観察研究では30日死亡率が37%で,分離株の28%でセフィデロコール耐性が確認されている
β-ラクタム以外にも新しいテトラサイクリン誘導体が臨床使用されている
エラバサイクリンはMDR-GNBに対し優れた活性を示し,FDAとEMAの承認を受けている
エラバサイクリンは,ESBL,CRE,CRABに対する活性を含むチゲサイクリンと同等の活性スペクトラムを持つが,P.aeruginosaに対する活性はなく,CREに対するMIC濃度はチゲサイクリンよりも2-4倍低い
開発中
MDR-GNBの場合,エラバサイクリン以外の新しい薬剤は静脈内投与が必要である
現状では,経口代替薬としては使用できない
テビペネムやスロペネムなどの経口カルバペネムは,ESBL-Eに対し活性が高く,第3相試験が行われている
日本ではテビペネムが承認されている
治療期間
近年は治療期間は短縮される傾向にあるが,MDR-GNBを対象としていない
GNR-GNBをを含む対象については,診療試験が進行中(ASPIC)
https://clinicaltrials.gov/study/NCT05124977
また,プロカルシトニンの使用も良いかもしれません
結果がでたものは
OPTIMIZE
https://ccforum.biomedcentral.com/articles/10.1186/s13054-024-05178-6
BALANCE
https://www.nejm.org/doi/full/10.1056/NEJMoa2404991
まとめ
MDR-GNB感染症は、今後も世界的な大きな問題
診断や抗菌薬治療は進歩している
根本的な耐性メカニズムを迅速に検出する能力が向上したことで、特定のメカニズムを標的とするMDR-GNB感染症に対する抗生物質使用の有用性の最大化を図る必要がある
診断法の進歩に伴うAMRの早期検出は、感染予防・対策の観点から重要である
所得の低い国では、検査インフラの整備に問題がある
逆にリソースが豊富な国であっても、抗生物質の使用に関して経済面での革新が必要
加えてこれらの新規治療・診断においては、臨床研究が有用であることは当然
MDR-GNBの場合、十分な症例数の確保が困難
そのためベイジアンモデル、個別化抗生物質戦略の比較逐次多重割当てランダム化試験、DURATIONデザインなどいくつかの臨床権試験デザインがこれらの欠点に対処している
薬剤耐性の悪循環を回避するには、抗生物質以外の方法を考える必要がある
すなわち感染予防・制御は基盤としてあり続ける