リウマチ性多発筋痛症や巨細胞性動脈炎は、リウマチ内科や総合内科ではよく遭遇する疾患の1つです。
経験的には、診断とステロイド導入〜導入後の管理までは総合内科で行うことが多いように思います。
ここで出てきます、トシリズマブなどのよりアドバンスな治療介入に関しては、リウマチ内科にコンサルテーションを行い、治療を行うことが多いように思います。
このように、簡単にリウマチ性多発筋痛症とか巨細胞性動脈炎とか書いていますが、大変なのは診断までの道のりです。
教科書的な症状で、慣れている医師が診察すればすぐに分かりますが、慣れている医師でも非特異的な症状ですと、確定診断までに時間を要することもあります。
また、Mimicといって似たような症状を来す疾患がたくさんありますので、それらの除外も必要になります。
最終的には、PETや生検に頼らざるを得ない場合もありますが、診断して治療介入を行うことが患者さんの生活の質(QOL)へ与える影響が大きいだけに、診断することが重要な疾患であると言えます。
Contents
はじめに
巨細胞性動脈炎(GCA)は、頭痛と時に急性視力低下を特徴とします。リウマチ性多発筋痛症(PMR)とGCAはほぼ50歳以上の人に発症し、発熱、倦怠感、体重減少、抑うつ、寝汗、赤血球沈降速度(ESR)やC反応性蛋白(CRP)などの炎症性マーカーの上昇などの症状が重複していることが多いです。
2015年のデータに基づいて、米国におけるPMRの年齢・性別調整済み有病率は50歳以上の人口10万人あたり701人、GCAの年齢・性別調整済み有病率は50歳以上の人口10万人あたり204人と推定されています。
PET−CTの新しい診断法の開発
PMRとGCAは、臨床的特徴、炎症マーカーの上昇の有無、画像診断に よって診断されます。GCAでは、超音波検査、PET−CT、MRI、CTにより、血管壁の肥厚による血管の炎症を示すことができます。側頭動脈生検(TAB)は、CGAを確認するための画像検査の代替手段です。
PMRの診断のための99人の患者を含むPET/CT研究では、感度85.1%特異度87.5%でした。
GCAの診断のための64人の患者を含むPET/CT研究では、感度71%、特異度91%でした。
GCAを対象とした研究の重要な側面は、頭蓋動脈も信頼性の高い最新のPET/CTプロトコルによって、評価することができるということです。
PET/CTは大動脈とその主要枝の病変が疑われるGCA患者や、PMRやGCAに類似した他の診断を除外する必要がある場合に最も有用です。PET/CTのいくつかの欠点は、検査の高額な費用(2018年のメディケアの平均償還額は約1377ドル)、放射線被曝、約2.4mmまでの分解能の内在的制限です。もう一つの限界は、グルココルチコイド治療の前または最初の数日以内にスキャンを得ることの難しさです。診断検査が利用できないためにグルココルチコイド治療の開始を遅らせることは、GCAの視力低下のリスクが差し迫っていることを考えると許容できず、PET/CTの感度はグルココルチコイド治療開始後に急速に低下するため、これは重要な欠点とされています。したがって、超音波検査は、PMRとGCAの初期診断のための主要な画像診断法とされています。
トシリズマブ(IL-6阻害薬)はPMR/GCA治療の承認を得たものの根拠に乏しい
グルココルチコイド治療は、PMRとGCAの両方に対して現在推奨されている第一選択の治療法です。一般的な副作用(最も一般的なものは骨粗鬆症、心血管系合併症、感染症、白内障、糖尿病、体重増加、およびクッシング体型)と関連しています。 PMR患者359人を対象とした研究では、糖尿病、動脈性高血圧、高脂血症、骨粗鬆症性骨折などのグルココルチコイド関連の有害事象を発症するリスクは、一般集団から得た年齢と性別をマッチさせた人に比べて高くはありませんでした。白内障のみが対照群よりもPMR患者に多くみられました。
メトトレキサートは、PMRとGCAの両方において、グルココルチコイドを抑制する戦略として使用することができますが、このアプローチは強力なエビデンスに裏付けられていません。GCAにおけるインターロイキン6受容体α阻害剤であるトシリズマブの有効性とグルココルチコイド抑制効果は、最近、GiACTA試験で実証されました。
これらの新しいデータを反映して、以前に発表された治療アルゴリズムが更新され、グルココルチコイド関連の副作用や 合併症、再発、治療の長期化のリスクが高い新規発症 GCA 患者、および再発を経験した患者に対して、第一選択のグルココルチコイド温存薬としてトシリズマブを使用することを推奨する内容になっています。 これらのサブグループの患者さんが、グルココルチコイド関連の毒性、費用対効果、治療期間への影響を軽減するという点で、トシリズマブ治療の恩恵を受けられるかどうかは、まだ実証されていません。
巨細胞性動脈炎の治療アルゴリズムの1例
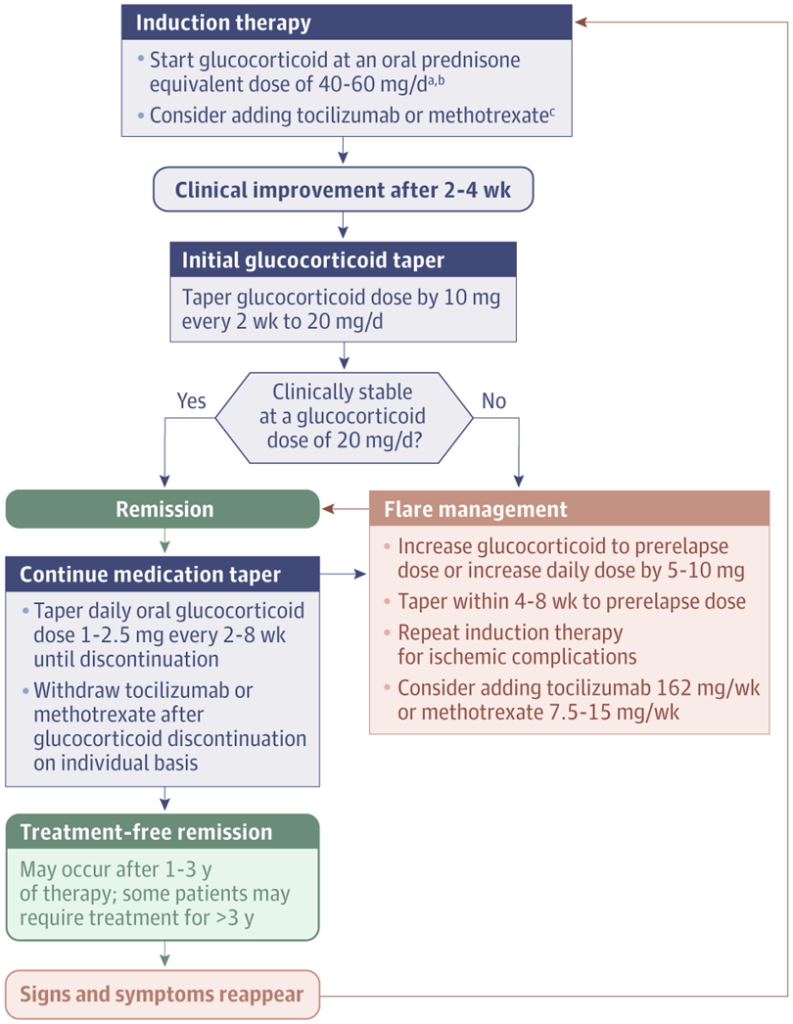
a メチルプレドニゾロン(0.5~1g/d)を3日間静脈内投与する(巨細胞動脈炎[GCA]合併および虚血性合併症のないGCA患者)。
b 視力低下が認められる場合は、対側の眼を保護するために、経口プレドニゾン相当量60mg/dでグルココルチコイドを開始する。
c GCAの場合、グルココルチコイドの副作用、再発、および/または治療の長期化のリスクが高い患者では、グルココルチコイドにトシリズマブ162mg/wk(またはメトトレキサート7.5~15mg/wk)を追加することを検討する;骨粗鬆症の予防または現在の推奨事項に従った治療を検討する。
投与量、投与経路、価格、その他の影響要因にもよりますが、トシリズマブはメトトレキサートの10~80倍の費用がかかります。例えば、米国ではトシリズマブの年間治療費は約18,500ドルです。
GCA患者41人を対象とした臨床試験では、プラセボと比較してアバタセプ トを投与された患者の12ヶ月時点での無再発生存率が高かったことが示されています。アバタセプトの潜在的な副作用としては、感染症、アレルギー反応、吐き気、頭痛などのリスクの増加が挙げられます。アバタセプトの年間治療費は約18,700ドルです。
まとめ
PET/CTの新しい研究は、GCAとPMRの診断アプローチを変えていない。両疾患を管理するための第一選択薬は依然としてグルココルチコイドです。トシリズマブは現在、第一選択のグルココルチコイド温存薬としてGCA患者の治療に承認されています。PMRの管理のための新しい戦略は明らかにされていません。