Contents
黄色ブドウ球菌菌血症について
https://jamanetwork.com/journals/jama/fullarticle/2832601
黄色ブドウ球菌菌血症の死亡率は,15-30%と高値とされています.
一般的な細菌ですが,一度菌血症になってしまうと慎重な対応が必要である細菌の代表と言えます.
菌血症になると,3分の1程度で転移性感染を起こします.
つまり,組織粘着性がつよい細菌です.
そのため,徹底的な駆逐が必要になります.
例えば,尿路感染症の代表的な起因菌である大腸菌(E.coli)と黄色ブドウ球菌では扱いが全く異なります.
転移性感染の代表
リスク要因
・最近の血管内デバイス
・外科手術
・注射薬の使用
・糖尿病
・過去のブドウ球菌感染症
48時間以上の持続菌血症では,90日死亡率が39%と高値とされています.
これは,持続菌血症の2人に1人弱が死亡する計算ですので,繰り返しますが徹底的に対処する必要があります.
先に書いたように,感染性心内膜炎の可能性は常に考慮されるべきです.
そのため,少なくとも軽胸壁心エコー検査は必ず行うべき検査の1つといえます.
さらに転移性感染も多く,先に上げたような遠隔感染巣を探す努力が必要です.
骨髄炎や硬膜外膿瘍の場合は,まずは身体所見で脊椎叩打痛などの所見が無いかを念入りに確認します.
感染性心内膜炎の場合は,いわゆる末梢サインと呼ばれる塞栓症状を探します.
同時に,骨の感染症の可能性も考慮されるべきですので,特に脊椎叩打痛などの所見は積極的に取りにいくべきでしょう.
症状があれば,MRIを撮像し所見がある部位の骨髄炎が無いかを確認します.
黄色ブドウ球菌菌血症診察の際は,エントリー(侵入門戸)が一般的にあります.
例えば皮膚の脆弱性がほとんどで問題になります.
先に上げた医療行為は,皮膚のバリア破綻を来す行為ですので黄色ブドウ球菌感染症のリスクが上がります.
他には,Atopyや何らかの皮膚脆弱性がある場合もリスクになりますので,これらの所見はデフォルトで取るようにしたいものです.
エントリーがあるということは次回以降も同じような感染症を来す可能性があります.
皮膚の脆弱性の観点から介入可能なものであれば,介入することで次回以降の感染症を減らすことができます.
黄色ブドウ球菌(S.aureus)はメチシリン耐性(MRSA)とメチシリン感受性(MSSA)に大別されます.
略語の後半のSAは,Staphylococcus Aureusのことでブドウ球菌です.
前半のMRはメチシリンResistanceの耐性と,メチシリンSensitiveの感性ということになります.
メチシリンについては,古典的な薬剤であり現在使われていないようですが,慣例的にこのように呼称されています.
要は,抗菌薬の中心であるβ-ラクタムやペニシリン系の薬剤が効かない細菌という感じです.
そのため,日本でよく使われる最強レベルに広範囲をカバーする抗菌薬である,メロペネムですらカバーできません.
つまり,メロペネムを使うようなシチュエーションで耐性ブドウ球菌もカバーしたい場合はバンコマイシンも加えて,いわゆる "メロバン" という組み合わせで使用されます.
歴史
それほど古くない2019年の報告では,黄色ブドウ球菌は世界135カ国で死亡原因の第一位とされています.
米国は欧州と細菌の疫学データが異なりますが,2017年に入院した多剤耐性感染症のうち,約半数の52%がMRSAによるものでした.
現代においても,黄色ブドウ球菌菌血症患者さんの90日死亡率は27%(95%Ci 21.5-33%)とされています.
2014年JAMAの黄色ブドウ球菌菌血症レビューでは,抗生物質療法の指針となる質の高い研究は1件でした.
過去10年間で診断・治療戦略に関する報告が蓄積され,2024年にはFDAは,セファロスポリン系であるセフトビプロールの規制承認を発表しました.
下記の研究では,ダプトマイシンに対し非劣性が示されました.
ERADICATE試験: https://www.nejm.org/doi/full/10.1056/NEJMoa2300220
疫学とリスク要因
先進国のデータでは,黄色ブドウ球菌菌血症の発生率は100万人年あたり,9.3-65例の範囲です.
危険因子には,血管デバイス,外科手術,男性は1.5倍,1歳以下や70歳以上の高齢者,社会経済的弱者,糖尿病,コルチコステロイドの使用,HIV感染,鼻腔へのコロニゼーションなどがあります.
日本では細菌あまり見かけませんが,予定手術では,鼻腔の除菌も行われているようです.
病態生理
黄色ブドウ球菌は約30%の人の鼻孔,皮膚,咽頭,消化管に常在しています.
血管デバイスなどを通じて細菌が血管の中に入ると,MSCRAMMによって媒介されます.
MSCRAMMは,接着マトリックス分子を認識する微生物表現成分とされています.
つまり組織粘着性が強い原因とも言えます.
MSCRAMMは黄色ブドウ球菌が,フィブロネクチン,フィブリノーゲン,コラーゲン,フォン・ウィルブランド因子,血小板など多くのヒトタンパク質に結合できるようにする表面タンパク質です.
表面に付着したブドウ球菌細胞の集合体は,多糖類,タンパク質,細胞外DNAからなるバイオフィルムマトリックスを形成し,ヒト免疫系による検出から細菌を保護します.
その後ブドウ球菌は低代謝状態となり,複製中の細菌に有効は抗生物質の感受性が低下します.
臨床症状
黄色ブドウ球菌菌血症の73%は発熱を呈します.
42%は悪寒を呈します.
18%は精神状態の変化を呈します.
感染創は骨関節(14.4%),血管内(17.8%),肺(5.9%),粘膜皮膚症状は18%に見られます.
ちなみに尿路感染症は極めて稀ですので,尿から検出された場合,通常は菌血症の可能性を考慮します.
診断
血液培養を取らなければ診断できません.
感度を上げるためには,通常は2セットが標準です.
分子診断検査では,mecA遺伝子などを数時間で検出できるようになっています.
分子診断テストがあることで,Gram染色から介入までの中央値は3.9時間,通常群は25.4時間と当然の結果ですが,有意に短縮しました.
またこれらの迅速診断は,ネットワークメタ解析の結果で死亡率の改善(オッズ比0.72,95%CI 0.59-9.87)と有用な結果となっています.
持続菌血症
適切な抗生物質療法にもかかわらず,3分の1は菌血症が持続します.
持続菌血症になると当然死亡率も上昇します.
ある前向きコホートでの90日死亡率は,持続で39%,非持続で22%でした.
これもまた当然ですが,持続菌血症だと遠隔感染症の発生が増加します.
菌血症の期間が2-4日で10%,5-7日で22%になりました.
1日で消失した場合は,6%ですので通常は24-48時間で繰り返す血液培養が必要とされています.
持続菌血症の場合は,市中発生の感染症でも多いとされます.
その理由は,入院中だと体温の変化などに気づきやすいですが,自宅だと慢性感染症で感染巣が増加,遠隔感染症となることも一因とされています.
単純性および複雑性黄色ブドウ球菌菌血症
合併症のない黄色ブドウ球菌菌血症は.以下の除外により定義されます
・心内膜炎が除外
・人工血管がない
・2-4日後の血液培養が陰性
・治療開始後72時間以内に解熱
・遠隔感染がない
感染部位の特定
心エコー検査
黄色ブドウ球菌菌血症の約12%で心内膜炎を発症します.
すなわち,黄色ブドウ球菌菌血症を生じた場合は全ての患者さんに心エコー検査が必要とされます.
経食道心エコー検査(TEE)のほうが当然感度は高くなりますが,IDSAガイドラインでは必須とされていません.
2807人のメタ解析では,TTEの感度は61%(95%CI,45-75%)でした.
ちなみに,TEEの場合は食道穿孔などが5000人に1人程度で発生するとされています.
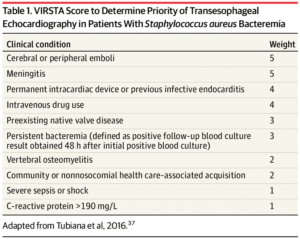
感染性心内膜炎の臨床予測ルール
VIRSTAスコア
スコアが低いほどリスクが低くなります.
3未満で,感染性心内膜炎の診断に対する陰性予測値は99.3%でした.
すなわち,スコアが3未満の場合はTEEを行わない妥当性の裏付けにもなります.
抗生物質の選択
MSSAのの場合で,中枢神経合併症の場合セファゾリンは移行性の問題で使えないとされていました.
現在トライアルが進行中のため,これらの結果次第ではセファゾリンでの(ドーズは増える可能性がありますが)治療が行われる未来もあるかもしれません.
SNAP: https://pubmed.ncbi.nlm.nih.gov/35717634/
CloCeBa: https://pubmed.ncbi.nlm.nih.gov/30173161/
MRSAの場合
日本ではたくさんありますが,FDAに認可されているものは3つになります.
・バンコマイシン
・ダプトマイシン
・セフトビプロール(2024年に承認)
当然,経験豊富な点やコストの面からも,第一選択はバンコマイシンになります.
バンコマイシンの欠点は治療域が狭く,腎毒性リスクを抑えるためにモニタリングが必要になります.
2剤目の追加としては,リファンピシン,ホスホマイシン,ダプトマイシン,β-ラクタム,セフタロリン等があるようです.
サブベージ療法
感受性のある抗菌薬を適切な量・経路で使用しても持続菌血症となる場合は,検討されます.
実際に臨床的には,たまにあります.
選択肢としては,MSSAの場合にセファゾリン+エルタペネム,β-ラクタム+ホスホマイシンがあります.
MRSAの場合は,バンコマイシンまたはダプトマイシン+セファゾリン,ホスホマイシン,セフタロリン,セフトビプロールがあります.
治療期間
低リスクで合併症がなければ,通常2週間です.
高リスクの場合は,4-6週間,もしくはそれ以上の治療期間が必要になります.
経口抗生物質への移行
有名な2018年のPOET試験では,黄色ブドウ球菌感染性心内膜炎に対する十分な検出力を備えていませんでしたが,経口抗生物質のオッズ比0.84,95%CI 0.15-4.78と同等とされています.
SABATO試験では,低リスク(非複雑性)黄色ブドウ球菌菌血症に5-7日の経静脈的治療後に内服スイッチと静脈内抗生物質継続の試験で合計14日間の治療が行われていました.
治療失敗率は経口群で13%,静脈群で12%と同程度でした.
ESC2023の感染性心内膜炎ガイドラインでは,黄色ブドウ球菌菌血症に対しても経口抗生物質への治療切り替えを支持しています.
感染源の管理
感染症の治療は,感染源のコントロールです.
抗菌薬はあくまでも,感染源のコントロールができない場合や感染源コントロール後の支持療法といった認識が適切かもしれません.
当然黄色ブドウ球菌菌血症の場合は,組織粘着性が問題になりますので治療の継続は必要です.
ただし,感染源を放置することで先に書いたように持続菌血症の期間や遠隔感染症を含む複雑性の病態へ進行する可能性があります.
そのため,できるもの(例えば膿瘍,デバイスなど)は早期に取り除くというのが基本になります.
感染巣の除去までが短いと,菌血症の消失は早くなります.
菌血症の期間が1日延長するごとに,死亡の相対リスクは1.16(95%CI 1.1-1.2,P<.001)と増加します.
最も早期に感染巣(可能性含め)のコントロールができるのは,カテーテルです.
人工関節やペースメーカーなどは安易な除去は難しいですが,カテーテルであれば黄色ブドウ球菌菌血症判明時に入れ替えが行われます.
カテーテルの抜去が遅れると(3日以上),黄色ブドウ球菌菌血症の再発率が上昇します(12.7%vs4.7%,P=.02 ).
予後
約53万人が対象の系統的レビューでは,推定死亡率は7日で10%,2週間で13%,1ヶ月で18%,3ヶ月で27%,1年で30%でした.
2020年の3万人を超えるコホート研究では,5年死亡率は61%でした.
死亡の予測因子は,加齢,合併症(心不全),アルコール使用障害,悪性腫瘍,免疫抑制,血液透析,診察時の重症度などがあります.
成人の黄色ブドウ球菌菌血症約3000人を対象としてプール解析では,90日以内の死亡率は29.2%でした.
感染源は不明の場合は,48.7%(90日以内の死亡率の調整ハザード比2.92(95%CI 2.33-3.67),P<.001でした.
これは臨床的な肌感覚とも概ね合致するように思います.
感染源が不明な状態で持続菌血症になる場合がありますが,大抵いつまでも菌血症の状態が改善しません.
また,一般的にはMRSAはMSSAと比較して死亡率が高いことが知られています.
感染症科コンサルト
約3万人を対象とした研究では,約半数が49.5%が相談を受け,5年間の追跡調査では再発や複合アウトカムの改善と関連していました(調整ハザード比0.71(95%CI 0.68ー0.74),P < .001).
ただしコンサルトの効果はベッドサイドのみで,遠隔相談については小規模RCTでは効果は見られませんでした.
進行中の研究